1. Définition
Les LAL sont des proliférations malignes aboutissant à l’accumulation clonale dans la moelle, le sang et éventuellement d'autres organes, de cellules immatures de la lignée lymphoïde, arrêtées au stade de lymphoblastes de la voie normale de différenciation.Une répression de l’hématopoïèse normale est présente, et les symptômes résultent de l'anémie, la neutropénie, la thrombopénie, et de l'infiltration des lymphoblastes dans les tissus.
Le traitement des LAL repose sur la chimiothérapie, éventuellement complétée par l'allogreffe de cellules souches hématopoïétiques : environ 3/4 des LA de l'enfant peuvent être guéries.
2. Incidence, étiologie, présentation clinique
2.1. Incidence.
Elle est de 1,5 nouveau cas pour 100 000 habitants / an, soit environ 1000 nouveaux cas de LAL par an en FranceElle représente 80% des LA de l’enfant et 20% des LA de l’adulte, avec 2 pics de fréquence :
chez l'enfant de 2 à 10 ans (75% des cas sont diagnostiqués avant 6 ans) et chez l’adulte à partir de 50 ans.
Elle est légèrement plus fréquente chez les garçons que chez les filles (1,3/1).
La LAL est plus fréquente chez les Caucasiens, et plus rare chez les noirs.
2.2. Etiologie
La cause des LAL est inconnue chez l'homme, mais correspondvraisemblablement aux résultats de l'interaction complexe de plusieurs étapes incluant la susceptibilité de l'hôte, des anomalies chromosomiques secondaires à des agents chimiques ou physiques, et probablement l'incorporation d'informations génétiques transmises de manière virale dans des progéniteurs sensibles.
Certaines anomalies génétiques constitutionnelles prédisposent aux leucémies (trisomie 21 et ataxie- télangiectasie) ; les polymorphismes du gène MTHFR, impliqué dans le métabolisme des folates, semblent moduler le risque de développer une LAL ; des toxines environnementales et des agents infectieux ont aussi un rôle à jouer. Cependant, seule l'exposition à la bombe atomique a montré une augmentation du nombre de LAL. La fumée de cigarette chez les fumeurs pourrait augmenter le risque de développer une LAL après 60 ans.
Parmi les causes infectieuses, le virus EBV est associé au lymphome de Burkitt.
Les LA secondaires après chimiothérapie (agents alkylants et inhibiteurs des topoisomérases 2) ou radiations sont le plus souvent myéloïdes (> 90 %), mais avec l'usage croissant des inhibiteurs des topo2 le nombre de LAL secondaires augmente.
2.3. Aspects cliniques
Présentation clinique souvent aiguë, avec histoire courte de fatigue ou de saignements spontanés.Syndrome tumoral avec polyadénopathies superficielles fréquentes et souvent une splénomégalie et une hépatomégalie (3/4 des enfants et ½ adultes).
Quelquefois des adénopathies profondes, médiastinales, plus évocatrices d’une LAL – T, ou une masse abdominale, évocatrice d’un lymphome de Burkitt.
Infiltration testiculaire. Rare, présente chez 2 % des garçons, souvent l'enfant et l'adolescent, associée à une hyperleucocytose et une splénomégalie.
Signes plus ou moins francs d’insuffisance de production médullaire, en rapport avec les cytopénies :
syndrome anémique
syndrome infectieux
syndrome hémorragique (saignement, épistaxis, pétéchies, ecchymoses)
Douleurs osseuses et articulaires. Plus fréquentes dans les LAL que dans les LAM, et on les observe plus souvent chez les enfants que chez les adultes.
Atteinte neurologique : plus fréquente dans les LAL que dans les LAM (neuropathies le plus souvent des 6ème et 7ème paire de nerfs crâniens, augmentation de la pression intracrânienne avec nausées, vomissements, maux de tête, oedème papillaire)
3. Diagnostic biologique
3.1. Hémogramme
- Anémie, parfois profonde (Hb < 7 g/dl)Normochrome, normocytaire, arégénérative (réticulocytes bas).
Remarque : une macrocytose dans une LAL au diagnostic évoque une carence vitaminique (consommation excessive de folates par les cellules tumorales)
- Leucocytes.
De la cytopénie franche (< 1G/L, sans blastes) jusqu’à l’hyperleucocytose majeure (> 100
G/L) constituée essentiellement de blastes.
Neutropénie fréquente, parfois sévère (< 0.3 G/L) nécessitant une démarche d’urgence (comme pour une agranulocytose)
Lymphocytes : nombre normal ou diminué
Remarques : Une polynucléose neutrophile, un excès de granulocytes basophiles, une hyperéosinophilie, caractérisent certains variants morphologiques de LAM ; cependant une
hyperéosinophilie est possible au diagnostic d’une LAL
Une hypermonocytose caractérise les LAM à composante monocytaire
- Thrombopénie dans la majorité des cas, pouvant être majeure (< 10 G/L)
Remarque : le bilan d’hémostase retrouve un tableau proche de celui d’un syndrome de défibrination dans 10% des cas (pts hyperleucocytaires)
- Examen du frottis sanguin
Il n’y a pas de dysmyélopoïèse (neutrophiles, hématies, plaquettes) dans les LAL au diagnostic.
Une érythromyélémie avec blastose modérée (15 – 30%) est classiquement décrite pour le lymphome de Burkitt disséminé, correspondant à l’ancienne LAL3-FAB.
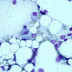
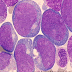
3.2. Frottis médullaire
Habituellement richement cellulaire. Dans 10 % des cas, la moelle est hypocellulaire (liée à une discrète myélofibrose)Mégacaryocytes : en général absents ou très rares (en rapport avec la thrombopénie)
Blastose médullaire habituellement > 90%
Aspect morphologique des lymphoblastes :
Les images de mitoses sont plus fréquentes dans les LAL-T et les LNH Burkitt disséminés.
5-10% des LAL peuvent présenter des blastes avec granulations (orangées ou grisées), plus souvent des LAL communes (visible également dans les crises blastiques de LMC)
Remarques : Quelques LAL présentent des particularités morphologiques.
- Dans les LAL T, on peut observer parfois une dysplasie granulocytaire.
- Une hyperéosinophilie, parfois majeure (> 10 G/l) peut s'observer dans quelques
cas de LAL-B1 avec t(5;14)(q31;q32), et l'éosinophilie peut précéder, être associée au
diagnostic, ou apparaître à la rechute. L’association éosinophilie avec masse médiastinale s'observe dans la LAL à précurseurs T, où il y a un excès de précurseurs myéloïdes immatures et une t(8;13)( p11;q12).
- La classification morphologique FAB (1976) n’est plus utilisée aujourd’hui ; la LAL3 ou LAL type Burkitt correspond au LNH Burkitt disséminé.
Réactions cytochimiques.
* Cytochimie de la myéloperoxydase : négative (ou < 3% pour tenir compte des éventuels myéloblastes résiduels). C’est la seule cytochimie réalisée aujourd’hui.
* D’autres cytochimies ont été autrefois réalisées, mais ne sont plus d’usage actuellement :
- PAS ou Periodic Acid Schiff qui met en évidence le glycogène (gros grains ou « flaques » rouges). Parfois positif également dans des LAM (monoblastes, mégacaryoblastes, proérythroblastes).
Phosphatase acide : positivité dans les lymphoblastes T.
3.3. Immunophénotype.
L’immunophénotype est indispensable pour confirmer le diagnostic ; il a été majeur pour le pronostic (aujourd’hui la cytogénétique est le facteur pronostique le plus fort)Il est défini en reprenant les stades normaux de maturation des cellules lymphoïdes dans la moelle osseuse et le thymus (classification EGIL)
85 % des LAL sont de la lignée B, et la LAL commune est la plus fréquente (60 %).
Dans environ 30% des cas un Ag myéloïde (ou deux, souvent CD33 ou/et CD13) est exprimé. Ce n’est que dans < 2% des cas qu’il faudra envisager la possibilité d’une LA biphénotypique
(voir le document « immunophénotype des LA »)
3.4. Anomalies cytogénétiques.
Leur recherche est indispensable au pronostic et influe sur la nature du traitement.
Chez l’enfant les principales chromosomiques (E2A, hyperdiploïdie, TEL-AML1, autres) sont
de bon pronostic avec > 80 % de survie sans évènement à 8 ans.
Chez l’enfant seules les Ph1 et anomalies mll sont de mauvais pronostic : survie de 25% à
6ans.
Chez l’adulte le pronostic est globalement péjoratif.
LAL – T : Les loci des gènes du TCR sont souvent impliqués : delta en 14q11, gamma en 7p14, bêta en 7q35 ; ils sont transloqués avec divers partenaires (TAL1 ou RBTN 1 ou 2 = rhombotine)
Ces diverses anomalies sont de bon pronostic : avec > 70 % de survie sans évènement à 8 ans.
Génétique moléculaire et DNA microarrays
La technique des DNA microarrays permet d'étudier l'expression de plus de 15 000 gènes dans un échantillon donné (détermination de la quantité relative de cDNA complémentaire).
Les techniques dites "supervisées" permettent la prévision de classe (on classe le cas étudié dans un groupe déjà connu), et les techniques "non supervisées" sont utilisées pour trouver
de nouvelles classes de pathologies (on classe les pts selon le profil d'expression génique).
Il est possible d'identifier et de séparer les LAL-B des LAL-T et des LAM, mais aussi de faire des classes en fonction des anomalies moléculaires: E2A-PBX1 [t(1;19)], TEL-AML1
[t(12;21)], BCR-ABL [t(9;22)], hyperdiploïdie.
Il est également possible d'identifier les pts qui ont risque élevé de rechute, et ceux qui sont sensibles à un type précis de chimiothérapie.
3.5. Autres examens.
L'examen du LCR est important : un nombre supérieur à 5 leucocytes/μl et la présence de blastes sont signes d'une localisation méningée.Biochimie
Dans les LAL de type 3 avec grand Turnover cellulaire, on peut observer des signes de lyse tumorale (hypocalcémie, hyperkaliémie, hyperphosphatémie, LDH augmentée, hyperuricémie, créatinine augmentée).
4. Diagnostic différentiel
* Lymphocytoses et hyperlymphocytoses de l'enfant- Coqueluche, lymphocytose infectieuse (maladie de Carl Smith) : tableau clinique généralement évocateur.
Hyperleucocytose parfois jusqu'à 60 G/l, mais absence d'anémie et de thrombopénie (souvent thrombocytose modérée). L’hyperlymphocytose est constituée d'éléments matures
au noyau parfois irrégulier ou encoché.
* Syndrome mononucléosique (surtout l’adolescent)
Dans la grande majorité des cas, la numération sanguine est beaucoup moins perturbée que dans les LAL, mais le tableau clinique, parfois bruyant, peut être inquiétant.
-Leucocytes: hyperleucocytose modérée fréquente ; les formes > 50 G/l sont rares.
-Hémoglobine : normale dans la vaste majorité des cas.
-Plaquettes : sont souvent modérément abaissées, mais rarement < 100 G/l.
La formule leucocytaire montre souvent une neutropénie modérée et une hyperlymphocytose avec nombreux lymphocytes activés. Les lymphocytes activés sont très pléiomorphes, du petit lymphocyte à la grande cellule hyperbasophile, témoin de l’activation des lymphocytes T agissant contre les lymphocytes B infectés par le virus EB.
Habituellement la grande hétérogénéité de taille, de forme, de basophilie cytoplasmique et de rapport N/C sont déterminants pour la discrimination morphologique.
* Leucémie aiguë myéloblastique peu différenciée ou indifférenciée
On retrouve les mêmes anomalies de l’hémogramme.
S’il n’y a pas de granulations azurophiles dans les blastes l'aspect peut être très proche d'une LAL à grands lymphoblastes. La cytochimie de la MPO est positive (> 3% blastes positifs) dans les LAM, sauf dans les quelques cas de LAM sans différenciation (LAM zéro).
Quand la cytochimie est négative, l’immunophénotype permet le diagnostic de LAM non différenciée.
* LA myéloïdes peu différenciées.
- LA mégacaryoblastique, LA proérythroïde : les blastes peuvent être très basophiles, ressemblant parfois aux blastes des LNH Burkitt leucémisés (immunophénotype et cytogénétique sont discriminants)
* Hématogonies dans la moelle.
Cellules de petite taille, au rapport N/C élevé, exclusivement médullaires, pouvant être retrouvées en nombre élevé (jusqu’à >50%) dans les myélogrammes, surtout chez les enfants dans diverses situations : régénération post-chimiothérapie ou post-greffe,
cytopénies non immunes ou immunes (PTAI), tumeurs solides, SIDA…. Morphologie hétérogène allant du lymphoblaste au lymphocyte dépourvu de cytoplasme. La cytométrie de flux permet dans les cas limites de bien les différencier des lymphoblastes tumoraux, notamment par un profil phénotypique non homogène, une expression plus faible du CD10 et un continuum de cellules dépourvues de CD 34 exprimant le CD 20 et une IgS.
* Localisation métastatique de tumeurs à petites cellules
- Les tumeurs malignes de l’enfant sont essentiellement des tumeurs à petites cellules rondes: neuroectodermiques, (neuroblastomes, rhabdomyosarcomes), ou épithéliales comme les néphroblastomes et les rétinoblastomes.
Les cellules ressemblent parfois à des lymphoblastes, mais on retrouve très souvent des aspects pseudosyncitiaux et de nombreuses cellules en lyse (catécholamines urinaires,
scintigraphie, immunohistochimie des cellules, cytogénétique aident au diagnostic)
- Certaines cellules de rhabdomyosarcomes ont une morphologie proche des cellules des LNH Burkitt.
Remarques : parfois érythromyélémie, mais habituellement absence de cellules anormales dans le sang (hémogramme peu perturbé)
* Phase de dissémination des LNH : surtout les LNH diffus à grandes cellules, mais également parfois les LNH de la zone manteau, voir certains LNH folliculaires.
* Crise lymphoblastique de LMC
1/3 des acutisations de LMC sont lymphoïdes. L’immunophénotype est toujours B et CD10+ (exceptionnels cas de phénotype T). L’histoire de la maladie est différente. Dans quelques cas on se pose la question d’une crise blastique inaugurale de LMC ou d’une LMC non diagnostiquée à la phase chronique. La biologie moléculaire (taille du gène de fusion bcr-abl) permet parfois une discrimination.
* Autres.
- La leucémie prolymphocytaire : les cellules sont nucléolées mais encore proches de
lymphocytes (agressivité clinique)
- La leucémie à plasmocytes : morphologie parfois « blastique » des plasmocytes ; tableau clinique différent.
- Les cellules de thymome, qui ont un phénotype de thymocytes communs et ne peuvent pas être distinguées des lymphoblastes des LAL T communes par l'immunophénotype (histologie
nécessaire).
- érythromyélémie : infections sévères, ostéopétrose, thalassémie majeure, localisation médullaire de tumeurs solides.
5. Facteurs pronostiques et bases du traitement
Les anomalies cytogénétiques, le profil immunophénotypique, l’hyperleucocytose, l’Hb, sont des facteurs pronostiques importants.Bases du traitement des LAL :
D’abord un traitement d’induction (corticoïdes, vincristine, asparaginase, parfois anthracyclines), avec une prophylaxie cérébro-méningée (méthotrexate), puis une
intensification (mêmes médicaments que précédemment), puis enfin un traitement d’entretien (sur une durée de 24 mois).
La surveillance du traitement comprend :
Au diagnostic :
Numération des blastes sanguins à J8 d’un traitement avec corticoïdes (apprécie la chute des blastes sanguins ; le nombre doit être < 1 G/L à J8) ; étude du LCR ; hémogrammes de
surveillance (prévenir une pancytopénie trop profonde) ; les myélogrammes sont réalisés après la cure d’induction, puis en fonction des schémas protocolaires (parfois pour expliquer
une cytopénie trop prolongée) ; un myélogramme à l’arrêt du traitement (éventuellement)
emc 2007
LEUCEMIES AIGUES LYMPHOBLASTIQUES (LAL)
 Reviewed by Admin
on
12:40:00
Rating:
Reviewed by Admin
on
12:40:00
Rating:
 Reviewed by Admin
on
12:40:00
Rating:
Reviewed by Admin
on
12:40:00
Rating:











Aucun commentaire: