I.
INTRODUCTION
1.
Définition:
§ Les
pneumopathies sont des infections aigues du parenchyme pulmonaire.
§ Elles sont
secondaires à des bactéries, virus, parasites, champignons.
II.
RAPPEL EPIDEMIOLOGIQUE
1.
Agents pathogènes:
|
Pneumopathies communautaires
|
Pneumopathies nosocomiales
|
|
§ Streptococcus.pneumoniae+++
§ Haemophilus.influenzae
§ Legionella.pneumophila
§ Mycoplasma.pneumoniae
§ Chlamydia.pneumoniae
§ Chlamydia.psitacci
§ Klebsiella.pneumoniae
§ Bacille de
Kock
§ S.aureus,
B.pertussis.
|
§ Pseudomonas.sp
§ Acinetobacter.sp
§ Entérobactéries
§ Staphylocoque.aureus
§ Bactéries
anaérobies
§ Légionella.pneumophila
|
2.
Réservoir :
|
Pneumopathies communautaires
|
Pneumopathies nosocomiales
|
|
§ Humain+++
§ Animaux
|
§ Humain
§ Environnement
+++
|
3.
Transmission :
§ Directe :
aérienne, inhalation
§ Indirecte :
inoculation/gestes invasifs
4.
Réceptivité :
§ Elle est fonction
de l’importance de l’inoculum, de la virulence du germe et des défenses de l’hôte
5.
Facteurs de risque :
§ Ages extrêmes
§ Insuffisances
respiratoires
§ Tabagisme,
alcoolisme
§ Immunodépression
6.
Aspects
épidémiologiques
§ Epidémique-sporadique
III.
PHYSIOPATHOLOGIE
§ Sur le plan
anatomique, il est important de distinguer les voies aériennes supérieures
septiques des voies aériennes inférieures sous-glottiques où la stérilité est
de règle.
§ Il est
nécessaire de distinguer les infections du parenchyme pulmonaire de celles des
voies respiratoires basses. Les infections des voies respiratoires sont les
bronchites (aigues ou chroniques). Elles sont le plus souvent d’origine virale
mais, Mycoplasma pneumoniae, Chlamydiae pneumoniae et Bordetella pertussis
peuvent être responsables de ces manifestations. Le rôle des bactéries
commensales des voies aériennes supérieures (S.pneumoniae, H.infleunzae et
B.catarrhalis) demeure controversé.
§ Chez les
patients atteints de BPCO, des bactéries résistantes (S.aureus,
entérobactéries, P.aeruginosa) peuvent être sélectionnées au cours des
antibiothérapies précédentes.
§ Les infections
parenchymateuses sont les pneumonies ou pneumopathies et les abcès.
§ Après inhalation
des germes il y aura ± destruction par les défenses naturelles (mécaniques,
cellulaires, immunitaires) ces défenses sont courcircuité en cas d’inhalation
(fausse route…), d’inoculation directe (fibroscopie…) et en cas de septicémie.
§  Lorsque ces défenses sont dépassées (inoculum important,
surinfection sur infections virales, stase bronchique, froid), il y aura
multiplication bactérienne + sécrétion enzymatique + capsule (bactéries
capsulées : pneumocoque). Ceci entraine une inflammation et une
destruction cellulaire de l’épithélium respiratoire Alvéolites qui peut rester localiser
ou s’étendre vers le tissu interstitiel (pneumopathie aigue ou chronique).
Lorsque ces défenses sont dépassées (inoculum important,
surinfection sur infections virales, stase bronchique, froid), il y aura
multiplication bactérienne + sécrétion enzymatique + capsule (bactéries
capsulées : pneumocoque). Ceci entraine une inflammation et une
destruction cellulaire de l’épithélium respiratoire Alvéolites qui peut rester localiser
ou s’étendre vers le tissu interstitiel (pneumopathie aigue ou chronique).
IV.
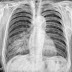
ASPECTS CLINIQUES
|
Pneumopathie aigue franche lobaire
|
Pneumopathie intersititielle
|
|
§ Typique,
fréquente
§ 39°C-40°C +
frissons
§ Signes respiratoires+++ : toux, expectorations purulentes, dyspnée, douleurs
thoraciques.
§ Imagerie :
opacité lobaire systématisée
§ Complications :
pleurésie, abcès de poumon, sepsis.
|
§ Atypique
§ 38,5°C-39°C
§ Signes généraux +++
§ Signes
respiratoires
§ Signes
extrarespiratoires
§ Syndrome
interstitiel : opacités nodulaires mal
systématisées.
|
V.
DIAGNOSTIC
BACTERIOLOGIQUE
1.
Indications :
§ Pneumopathies
graves nécessitant une hospitalisation
§ Echec d’une antibiothérapie probabiliste
§ Terrains
fragiles
§ Pneumopathies
nosocomiales
2.
Eléments
d’orientation :
§ Age
§ Vaccinations
ultérieures
§ Terrain :
BPCO, alcoolisme, immunodépression, splénectomie, toxicomane IV
§ Profession
(contact avec les oiseaux)
§ Prise
d’antibiothérapie (bêta-lactamines +++)
v Germes à recherche
en fonction du terrain :
§ B.P.C.O : Pneumocoque, H.influenzae,
K.pneumoniae, S.aureus.
§ Ethylisme :
Pneumocoque, K.pneumoniae,
anaérobies.
§ Ages
extrêmes : Pneumocoque,
H.influenzae, S.aureus, Streptocoques pyogènes.
§ Adulte
immunocompétent : Pneumocoque,
M.pneumoniae
§ Immunodepression :
pneumocoque, H.influenzae, P.aeruginosa, S.aureus, Nocardia.
§ Pneumopathie
inhalation : Anaérobies, entérobactéries flore endogène.
v Problèmes du
diagnostic bactériologique :
§ Germes fragiles
§ Contamination
par la flore commensale
§ Association de
plusieurs germes : P. nosocomiales +++
§ Bactéries
difficilement cultivables.
v Démarche diagnostic
bactériologique :
3.
Prélèvements :
§ Respiratoires +++ (expectorations, AET, CDP, BDBP, LBA)
§ Hémocultures
§ Prélèvement ORL
§ Sérum
§ Urines
(détection d’Ag solubles de pneumocoque et L.pneumophila)
§ La qualité du prélèvement conditionne la
qualité des résultats
§ Il faut éviter
la contamination du prélèvement
§ Transport
immédiat dans un tube stérile.
§ Pour des cas
simples, chez des patients ayant un état général conservé, l’analyse bactériologique
des expectorations convenablement recueillies et lavées peut fournir des
résultats acceptables. En revanche, si le processus infectieux présente un
caractère vital, la réalisation d’un prélèvement fiable : aspiration
endotrachéale, mini LBA, brossage distal protégé ou cathéter distal protégé
sera nécessaire, il en est de même si une étiologie à bactérie anaérobie est
suspectée.
a.
Expectoration (ECBC):
§ L’expectoration
est le seul prélèvement respiratoire réalisé par patient, il doit être
réalisé :
Ø A jeun ;
Ø Après rinçage
buccodentaire à l’eau distillée stérile ;
Ø Après un effort
de toux ou après kinésithérapie.
§ Le prélèvement
est recueilli dans un tube à fond conique. L’exudat produit doit provenir d’une
origine profonde et ne pas être un exsudat rhinopharyngé contaminé par la
salive.
§ Le prélèvement
doit répondre à des critères pour être utilisable.
b.
Fibro-aspiration et
aspiration endotrachéale (AET) :
§ Elle est
réalisée lors d’une fibro-bronchoscopie chez les malades atélectasiques
(nourrissons).
c.
Cathéter distal
protégé :
§ L’aspiration
bronchique à l’aide d’un cathéter distal protégé est réservée aux malades
intubés et ventilés à lésions bilatérales.
§ Fait à
l’aveugle.
d.
Brossage distal
bronchique protégé :
§ Cette technique
associe les avantages de la fibroscopie, prélèvement dirigé au niveau du foyer
infectieux et de l’aspiration trachéale, par ailleurs elle permet de limiter la
contamination par la flore pharyngée du fait de la protection de la brosse par
un double cathéter obturé d’un bouchon amovible terminal qui est introduit par
le canal du fibroscope.
e.
Liquide
broncho-alvéolaire (LBA) et mini-LBA :
§ Réalisé sous
fibroscopie.
§ Le LBA est plus
particulièrement destiné à la recherche de virus (cytomégalovirus), de
parasites (Pneumocystis carinii), de champignons (levures), mais aussi à la
recherche de certaines bactéries (légionelles, Nocardia, actinomycètes).
f.
Autres
prélèvements :
§ Tubage
gastrique : réservé surtout à la recherche de mycobactéries
§ Biopsies
pulmonaires
§ Aspirations
naso-pharyngées : recherche de chlamydiose
4.
Eléments non
bactériologiques du diagnostic :
§ L’examen
cytologique des expectorations est important pour valider le caractère profond
du prélèvement et permet ainsi d’éliminer ceux dont l’origine salivaire est
certaine. Les critères retenus sont détaillés dans le tableau 1.
5.
Diagnostic
direct :
a.
Aspect
macroscopique : couleur consistance :
§ Purulent
§ Muco-purulent
§ Hémorragique
§ Visqueux
§ Salivaire
§ Odeur fétide
§ Présence de
grain
b.
Traitement des prélèvements au
laboratoire :
§ Décontamination
(ECBC, Prélèvement transtrachéal +++) : rinçage/eau physiologique stérile
§ Fluidification
(N-acetyl-cystéïne 30 min 37°)
§ Dilution /eau
physiologique stérile au 1/10 ou 1/100 pour faciliter dénombrement des colonies (PDP)
c.
Ensemencement :
§ A l’aide d’une
oese calibrée (10ul) +/- dilution : dénombrement des colonies par ml
(ensemencer en étoile)
§ Milieux :
Ø GS (+
optochine/bacitracine),
Ø Chocolat,
Ø Chapman (Staph)
Ø GS+ acide
nalidixique en anaérobiose
Ø Sabourauld
(levures)
§ Autres milieux :
Ø CYE, BCYE (L.
pneumophilia)
Ø Coletsos,
lowenstein (mycobactéries)
d.
Incubation :
§ 37° (18-24h) +
5% CO2
e.
Examen direct :
culot de centrifugation
§ Etat frais :
Ø Germes, levures,
filaments mycéliens, cellules (buccales, pharyngées, bronchiques, alvéolaires,
macrophages, PNN, GR) Apport MGG
§ Gram :
Ø Cocci gram + en
diplocoque (pneumocoque)
Ø BGN polymorphes
(H.influenzae)
Ø BGN :
Entérobactérie, Pseudomonas
Ø Coccobacilles
Gram - : Acinetobacter
Ø Préciser caractère
monomorphe :
pathogène
§ Ziehl nelson : BAAR
f.
Dénombrement-identification :
§ Critères d’identification :
Ø Poussent milieux
ordinaires, sélectifs
Ø Aspect colonies
Ø Gram
Ø Oxydase,
catalase
Ø Galerie
classique, galerie API, exigence en facteur X et V
§ Dénombrement des colonies :
Ø Exemple : 100 colonies 10µl 104 UFC/ml
g.
Antibiogramme :
§ Obligatoire-
CA-SFM
h.
Détection des Ag
solubles :
§ Détection plus
précoce des infections pulmonaires
§ Prélèvements :
ü Expectorations,
secrétions purulentes respiratoires, urines, LCR, sérum
§ IFD :
ü L.pneumophila
ü Mycoplasma.pneumoniae
ü C.pneumoniae/ psitacci
ü C.burnetti
§ ELISA,
agglutination/des particules de latex sensibilisées par des AC
monoclonaux :
ü S.pneumoniae
i.
Détection du
génome :
§ Pour les germes
dont la culture est délicate.
§ PCR, PCR en
temps réel +++
ü L.pneumophila
ü Mycoplasma.pneumoniae
ü C.pneumoniae/ psitacci
ü C.burnetti
ü B.pertusis
6.
Diagnostic
indirect :
§ Rétrospectif
§ Utilisé lorsque
le diagnostic direct est difficile
§ Il faut 2 sérums
à 15j d’intervalle
§ Séroconversion :
IgM (+) / Multiplication du taux par 4
§ Techniques :
ü ELISA
ü IFI
ü Fixation du
complément
§ Bactéries
recherchées :
ü M.pneumoniae
ü L.pneumophila
ü C.pneumoniae/ psitacci
ü B.pertusis :
intérêt : recherche des IgA : si (+) : infection récente, si
absent : sujet vacciné.
7.
Diagnostic
étiologique
a.
Pneumocoque :
§ Il est responsable
de 50% des pneumopathies aigues
§ C’est un CGP en
diplocoque, capsulé, immobile, en flamme de bougie
§ Sur gélose au
sang : colonies transparente, ronde, 1mm, hémolyse α
§ Catalase (-), sensible
à l’optochine, lyse bile (+)
§ Ag
capsulaires : technique d’agglutination (expectoration, urine, LCR, sérum)
§ Antibiogramme :
ü Inoculum
important 108 UFC/ml
ü Gélose au sang
ü Interprétation
de la sensibilité aux bêta-lactamine en fonction du diamètre de l’oxacilline
(>26 : S/ <26 : PDSP (CMI))
b.
Haemophilus.influenzae :
§ Responsable des
pneumopathies aigues
§ Petit BGN,
polymorphe, capsulé, immobile
§ Culture :
ü Gélose chocolat
polyvitex
ü Colonies
muqueuses ou lisses
ü Exigence en
facteur V+X + satellitisme avec le S.aureus
§ Galerie NH
§ Ag
capsulaire : technique d’agglutination latex, ELISA
§ Antibiogramme :
ü Inoculum 106
UFC/ml
ü Détection de
bêta-lactamase par le disque de nitrocéfine (céfinase ®)
c.
Legionella.pneumophila
§ Responsable de
légionellose (pneumopathie atypique)
§ Transmission :
hydrique par inhalation
§ BGN, court,
mobile, aérobie +++
§ Culture :
ü Milieu BCYE
2-15j
ü Colonies en tête
d’épingle à la loupe binoculaire
§ Ag
solubles : pour L.P sérotype 1
§ PCR
§ Sérologie
importante +++ LP1
d.
Mycoplasma.pneumoniae :
§ Agent Eeaton
§ Responsable de
pneumopathies atypique
§ Bactérie sans paroi
§ Non visible au
MO
§ Culture :
milieu Hayflick
§ Diagnostic
surtout :
ü IFD
ü PCR
ü Sérologique
e.
Chlamydia.pneumoniae/psittaci
§ Responsable de
pneumopathie atypique
§ 2 formes :
ü Corps
élémentaire : infectieux
ü Corps
réticulé : intracellulaire
§ Bactérie intracellulaire obligatoire
§ Culture
cellulaire
§ Diagnostic :
ü IFD
ü PCR
ü Sérologique
f.
Entérobactéries :
K.pneumoniae, Enterobacter, Serratia, E.coli, Proteus
§ Responsables des
pneumopathies nosocomiales, post-inhalation.
§ BGN :
caractères communs des entérobactéries
§ Cultures :
ü Milieu sélectif
pour BGN : DCL
ü Colonies
muqueuses, bombées, lactose +
§ Identification :
galeries classiques, API E
§ Antibiogramme :
germes multi R BLSE
g.
Pseudomonas :
§ Responsable de
pneumopathies nosocomiales
§ Aérobie
§ BGN non
fermentant, oxydase (+), mobile
§ Culture :
colonies pigmentées vertes, bleu
§ Antibiogramme :
multirésistance naturelle et acquise
h.
Acinetobacter :
§ Responsable de
pneumopathies nosocomiales
§ Coccobacille,
immobile
§ Colonies
bombées, oxydase (-)
§ Germe
multirésistant
VI.
TRAITEMENT ET
PREVENTION
1.
Traitement
a.
Pneumopathies
communautaires non compliquées :
§ P.aigue
franche :
ü amoxicilline 1g
×3J pendant 10J ± macrolide si pas d’amélioration après 48H
§ P.
interstitielle :
ü Macrolide ou
cycline ± amoxicilline
ü Fluoroquinolone
§ Terrains à
risque :
ü C3G
ü Amoxicilline +
ac.clavulanique Inj
ü +
fluoroquinolone
ü Hospitalisation
b.
Pneumopathies
nosocomiales :
§ imipénème + amikacine
§ Vancomycine
2.
Prévention :
§ Vaccination :
pneumocoque chez les sujets à risque
§ Mesures
spécifiques de prévention contre les infections nosocomiales
LES PNEUMOPATHIES BACTÉRIENNES
 Reviewed by Admin
on
15:23:00
Rating:
Reviewed by Admin
on
15:23:00
Rating:
 Reviewed by Admin
on
15:23:00
Rating:
Reviewed by Admin
on
15:23:00
Rating:












Aucun commentaire: